 |
山本 隆行(ヤマモト タカユキ)【IBDセンター長】 IBDセンター |
 |
下山 貴寛(シモヤマ タカヒロ) IBDセンター |
はじめに
皆さんもご存知のように、生活様式の欧米化により日本でも炎症性腸疾患(IBD)が急増しています。
IBDとは、潰瘍性大腸炎とクローン病の2つの疾患を指します。
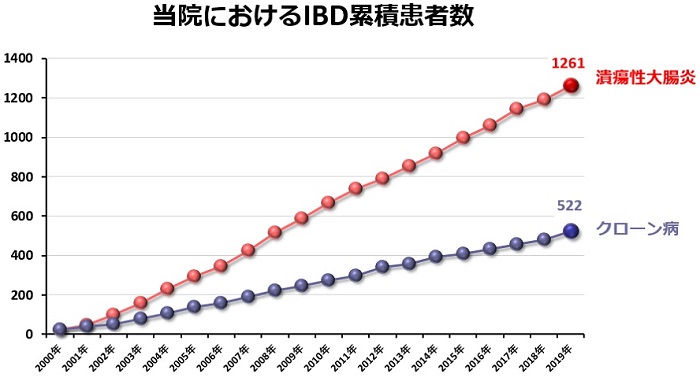
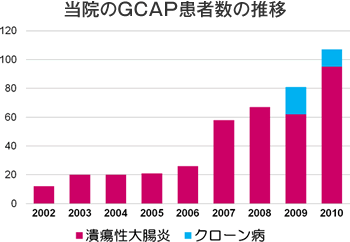
四日市羽津医療センターでは「IBDセンター」を開設してIBDの診療に力を注いでおり、みえIBD患者会の運営、IBD研究会の開催および難病相談会への参加など、多くの啓蒙活動を行っています。下図に当院で診療を受けられた累積の患者さんの人数を各年毎にお示しします。IBDの患者さんの数は、潰瘍性大腸炎もクローン病も年々増加しています。これまで当院では、潰瘍性大腸炎は1200人、クローン病は500人の患者さんが診療を受けてこられました。また、最近では、県内外で診断や治療に難渋している患者さんや術後合併症を併発した患者さんが多く紹介されるようになっています。
IBDチームの結成
IBD は治療法が多岐にわたり複雑な為、適切な治療を行うためにはいろいろな職種の協力や連携が必要になります。当院では、医師、看護師、薬剤師、栄養士、臨床工学技師、臨床心理士、メディカル・サポート・グループ(MSG)が団結して多職種連携IBDチームを結成しました。定期的にカンファレンスを開き、患者さんの病態や治療法(薬剤および手術)やについて討論したり、勉強会や研究会を行い知識を高めたり、患者さんの治療がスムーズに進むように各部署の連携を強化したり、他にもいろいろな活動を行っています。また、みえIBD患者会の事務局が当院に置かれており、定期的に患者さんやご家族を対象に患者会(下記)や調理実習会などを開いています。三重難病連が主催する難病相談会にも積極的に参加し、疾患に関する医療情報、就労活動や労働条件、妊娠や出産、経済的な問題(医療費や医療福祉)などについての相談や支援を行っています。さらに、施設間で患者さんの紹介が円滑に行えるように、北勢地区の病院が参加する勉強会を年に数回開催して連携が取れる体制を整えています。また、全国のIBD研究会で講演活動も行っています。
患者さんが安心して質の高い満足のゆく治療を受け、元気に社会復帰してくださることがチームの望みです。「この病院に来て治療を受けて良かった」と言っていただけるのが最高の喜びです。これからも患者さんや家族に貢献できるようなチームにするために全員一丸となって精進してゆきます。私どものチームの活動の一部をご紹介します。また、最新情報も含めたIBD治療について詳細にご説明しています。是非、ご覧ください。
当院のIBDチーム
各チームごとの詳細をpdfファイルにて掲載しております。
平成24年3月17日に「みえIBD研修会」で開催されました各チームごとの講演内容をPDFファイルにて掲載しております。
3月17に「CTYケーブルテレビ」にて放映された内容です
みえIBD患者会
 患者さんやご家族を当院にお招きし、IBDの正しい知識をつけていただくように、専任講師の講演や患者さんの体験談を聞いていただています。質問も御自由です。料理教室を開くこともあります。同じIBDと闘っておられる患者さんやご家族とお知り合いにもなれる貴重な場です。
患者さんやご家族を当院にお招きし、IBDの正しい知識をつけていただくように、専任講師の講演や患者さんの体験談を聞いていただています。質問も御自由です。料理教室を開くこともあります。同じIBDと闘っておられる患者さんやご家族とお知り合いにもなれる貴重な場です。
「みえIBD」患者会のご紹介(pdf)
IBD患者会の様子(pdf)
このホームページでは、IBDと診断された(あるいは疑われている)患者さんが、適切な知識をもって安全で有効な治療を受ける手助けとなることをIBDチームが願って作成したものです。現在、当院で行っている治療法やその成績をご紹介しています。ご質問のある方は、当院にご連絡ください。
なお、潰瘍性大腸炎やクローン病のもっと基本的なことを知りたい方は、以下のサイトなどをご参考ください。
難病情報センター「潰瘍性大腸炎」
http://www.nanbyou.or.jp/entry/62
難病情報センター「クローン病」
http://www.nanbyou.or.jp/entry/81
「IBD情報」
http://www.ibd-nandarou.jp/
http://www.ibd-life.jp/
- 当院では、レミケードの点滴注射や血球成分除去療法を受ける患者さんのために専用の治療室を設けました。仕事や学校の終了後に治療を受けられるようになりました。
- 当院の4階病棟にみえIBD事務局を併設しています。IBDの情報誌・食事レシピ・患者会などの資料をご自由に閲覧できます。
- 当院におけるIBDチームが、CCJAPANというIBDの総合情報誌(48巻と50巻)やアステラス・スクエアという医療情報誌(4・5月号)で紹介されました。ご覧ください。

当院では現在、新薬や新しい治療法の臨床試験を多数行っています。海外の施設とも共同研究を行っています。これらの試験の結果は、今後のIBDの治療に役立つ貴重なデータとなります。当院で行われた多数の臨床試験の結果が国内外で報告されています。
これまでの治療が効かない患者さんや臨床試験に興味のある方は、遠慮なくご連絡ください。ご相談のうえ、適切な臨床試験があればご紹介いたします。
当院でのIBD治療の基本方針
- 早期に寛解に導き、寛解を長期間維持する。
- ステロイドを漫然と投与しない。
- 必要時には、外科的治療(手術)を速やかに行う。

IBDでは寛解(症状が落ち着いている状態)期と活動(症状が見られる状態)期が交互に見られます。活動期の患者さんに適切な治療を行い出来るだけ早く寛解に導き、その寛解を長期間維持する必要があります。寛解期には再燃や再発(再び悪化すること)を防止する為に一般的に寛解維持療法を行います。IBDにも様々な病態があります。軽症の患者さんや寛解状態の患者さんに、副作用を伴う強い薬剤を投与する必要はありません。とくにステロイドは、必要な際に投与して速やかに減量し中止するべき薬剤です。慢性的にダラダラと長期間投与すると少量でも副作用に苦しむことになります。
IBDでは大出血や腹膜炎(激しい腹痛)を起こしている患者さんには、緊急手術が必要です。
また、内科的治療が有効でないときにも手術が必要なことがあります。手術はできれば避けたいですが、
- ステロイドが長期間投与され副作用に苦しむ患者さん
- 長期間腹部症状が続き、食事が摂れず体重が減少して常に全身倦怠感が強い患者さん
- 頻回に入院加療が必要で社会生活が送れない患者さん
などは、手術を受けると薬剤から解放され食事も十分摂取でき良好な健康状態を取り戻すことができます。手術適応についてはIBD専門の外科医に相談されることをお勧めします。手術は患者さんのQOL(生活の質)を向上させるものであって決して敗北ではありません。手術が無事終わってそこから新しい生活が始まるのです。
IBDの新しい治療戦略 (Treat to target)
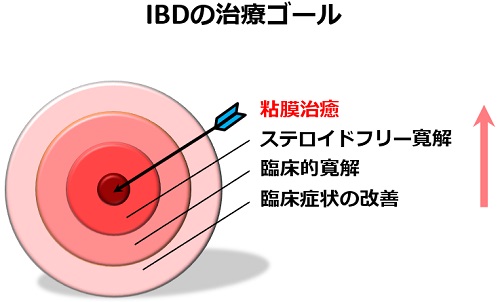
近年、IBDにおいてTreat to target (T2T)という治療指針が注目を集めており、その有用性が報告されています。T2Tとは、臨床症状の改善に加えて、内視鏡検査などによる積極的な病変活動性の評価を行い、粘膜治癒(内視鏡的な炎症の消失)を達成をさせることを治療目標として、薬剤療法を早い段階から強化する治療戦略を意味します。すなわち、近年、IBDの治療目標は、臨床症状の改善からより高い目標である粘膜治癒達成へとパラダイムシフト(これまで当然と考えられてきたことが、劇的に変化することを意味します)を起こしているのです(図)。
便中炎症マーカー(カルプロテクチン・ラクトフェリン・ヘモグロビン)
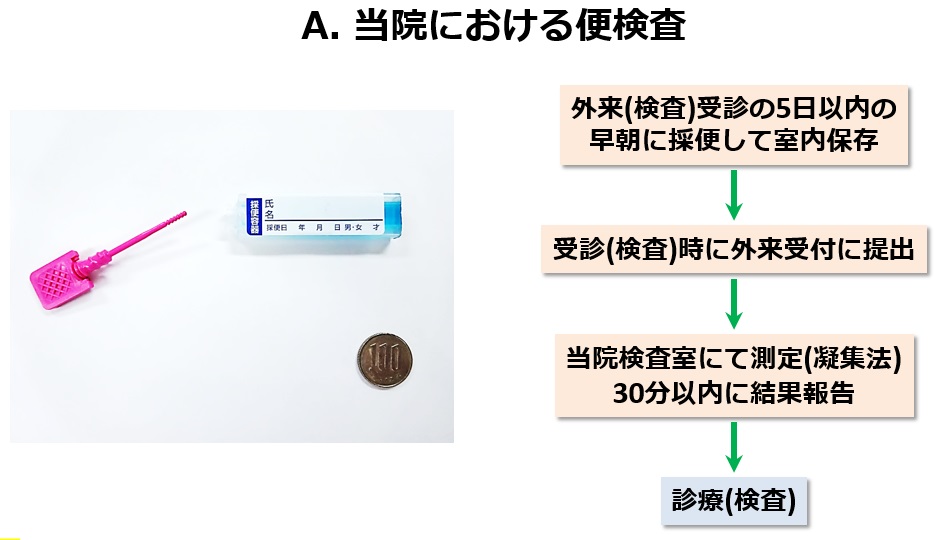
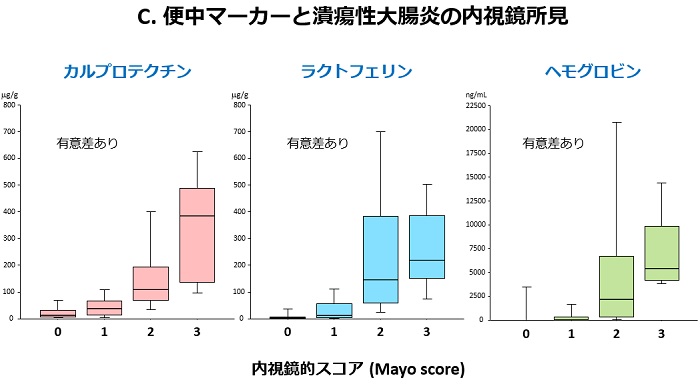
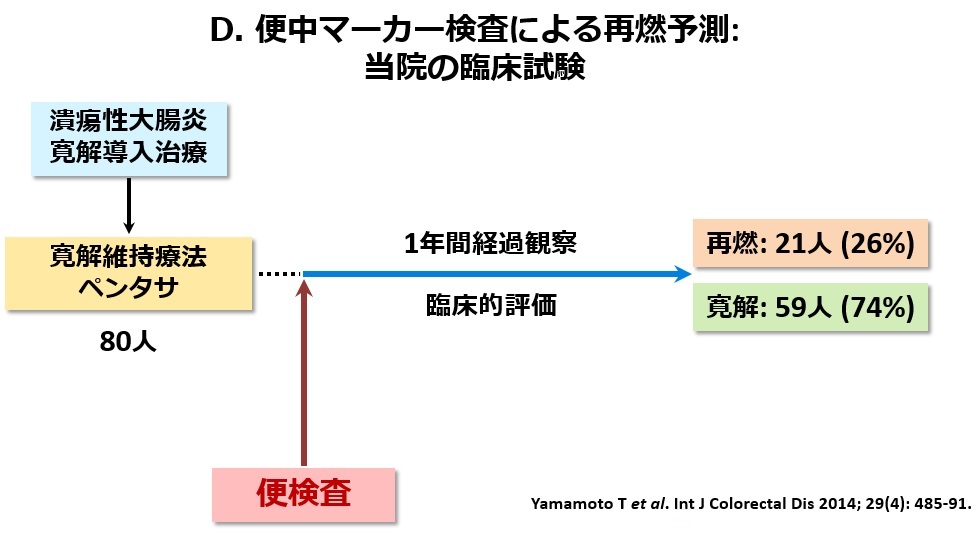
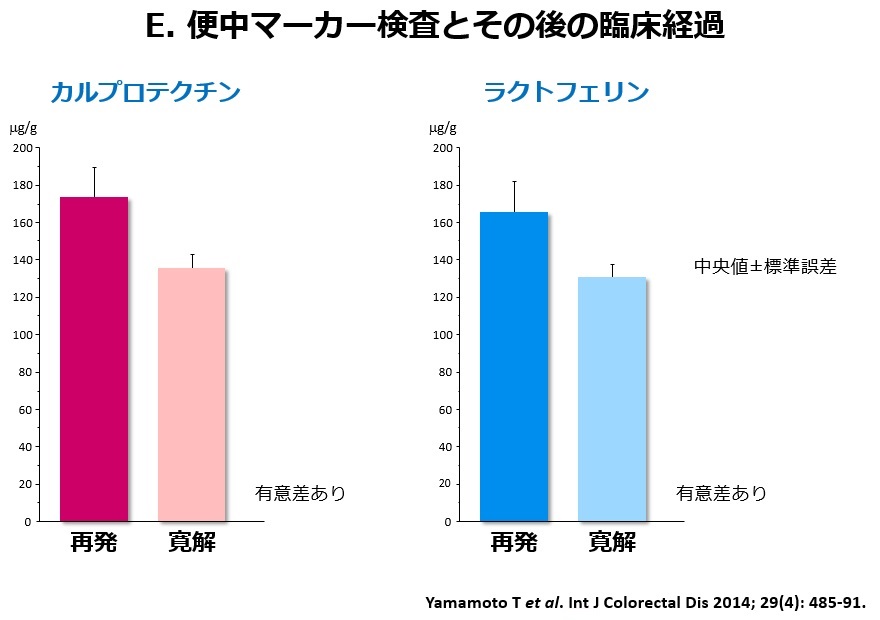
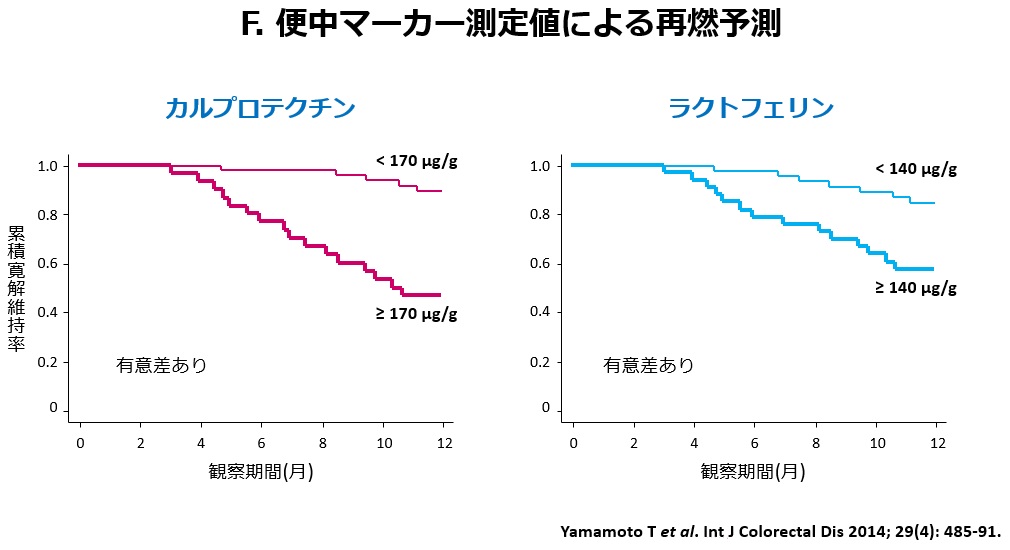
内視鏡検査は、痛みを伴い時間もかかるため、患者さんにとってはなるべく避けたい検査です。当院は、以前から便検査(カルプロテクチン・ラクトフェリン・ヘモグロビン)の研究を精力的に行ってきました。これらの検査は患者さんに少量の便を採取してもらい、便中の炎症性物質の濃度を測定する検査です(図A)。カルプロテクチンやラクトフェリンという物質は、主に好中球から分泌されるタンパク質の一種で、便中でも安定しているため、消化管の炎症マーカーとして有用とされています。また、便中ヘモグロビン検査はこれまで大腸癌の検診目的で用いられてきた便中の潜血を検出する検査ですが、最近では潰瘍性大腸炎でも有用であることが分かってきました。下記(B)にIBDにおけるこれらの便中マーカーの有用性を箇条書きにしました。便中カルプロテクチンは、IBDと機能性疾患(過敏性腸症候群)の鑑別に有用です。IBDを疑わせる腹部症状がみられるがまだ診断がされていない患者さん(とくに内視鏡検査の施行が困難な小児例)において、内視鏡の前に行う検査として有用と言えます。腸管炎症を伴わない機能性疾患では便中カルプロテクチンの上昇は認められないからです。次の有用性では、便中マーカー(カルプロテクチン・ラクトフェリン・ヘモグロビン)は、図Cに示すように潰瘍性大腸炎の内視鏡炎症所見と強い正の相関を示します。すなわち、内視鏡の炎症スコアが上昇すると便中マーカーも高値を示します。すなわち、これらの便中マーカーは潰瘍性大腸炎の内視鏡病変の補助診断として有用ということになります。その他の有用性についてですが、新しい治療を導入した際に、主観的な臨床症状の評価だけでは治療効果の判定が困難なことがありますが、数値で現れる便中マーカー検査はより客観的に治療効果を評価しうるという利点があります。最後に、便中マーカーには寛解維持中の(臨床症状のない)IBD患者さんにおいて、将来の臨床経過(再燃や寛解)を予測しうるという有用性が存在します。図Dに示す当院での臨床試験において、便検査後の経過観察中に再燃を起こした患者さんでは寛解を維持した患者さんより便中マーカーの測定値が有意に高かったことが確認されました(図E)。すなわち、便中マーカーの測定値が高値であれば、その後の再燃の危険性が高いことを意味するのです(図F)。したがって、症状がなくても便中マーカーが上昇し始めれば、早期に治療を強化すれば再発が予防できる可能性があるのです。このように便中マーカーはIBDの臨床において非常に有用で非侵襲であることから、今後広く利用されることが期待されます。当院では、すでに患者さんの治療に積極的に用いています。最近、便中カルプロテクチン検査は潰瘍性大腸炎において本邦でも保険承認されました。

クローン病小腸病変の画像診断: CTエンテログラフィー
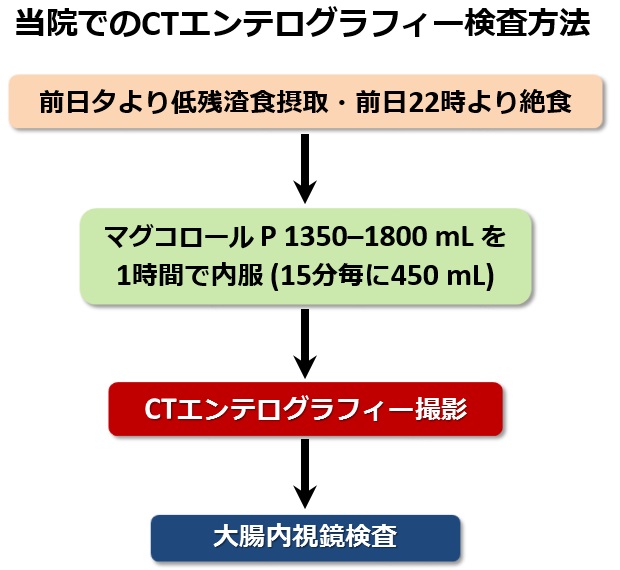
IBDの大腸病変は、(肛門に高度な病変のない患者さんでは)内視鏡検査で評価することが可能です。しかし、小腸を内視鏡にて全範囲をくまなく検査することは困難です。クローン病患者さんにおける小腸病変の評価には、いくつかの検査が用いられます。カプセル内視鏡検査は、小さな内視鏡を飲み込むと内視鏡が腸管内部を進みながら小型カメラで写真を撮像記録してゆきます。撮像後、カプセル内視鏡は自然排出されます。しかし、クローン病患者さんでは狭窄病変があるとそこでカプセルの滞留がおきてしまうことがあり、その際は手術が必要となってしまうこともあります。小腸造影検査(小腸透視)は、広く普及していますが、検査に時間もかかりますし、クローン病では最も重要な小腸終末部の評価が腸管が重なることにより鮮明な像が得られなくなるという欠点があります。超音波検査は、低侵襲で好ましい方法ですが、腸管内にガスが多いときは観察が困難になりますし、検査には熟練した技術と豊富な経験が必要です。当院では、エンテログラフィーという手法を用いて小腸病変の評価を行っています。この方法は腸管洗浄液を内服してもらい(1時間に1350-1800 mL)、小腸を拡張させた状態で画像撮影を行う方法です。この方法を用いることで、狭窄や炎症あるいは瘻孔部位を様々な角度で描出することができます。画像の撮影には、CTやMRIを用います。当院ではMRI検査は長時間を要し常に予約枠がいっぱいなため必要時に施行できないという欠点(利便性が悪い)があるので、CT検査を用いるCTエンテログラフィーという方法を行っています。当院のCT検査は低線量で被曝量も通常の1/3程度に抑えられており、さらに撮影時間が短くスムーズに施行することができます。下図に当院におけるCTエンテログラフィー検査の流れをお示しします。検査前日から入院していただき、夕方から低残渣食を摂っていただきます。検査当日にマグコロールという下剤を1時間で服用していただき、腸管を拡張させた状態でCTを撮影します。同日排便後に、大腸内視鏡検査を行うことで、1日で小腸と大腸の評価を一度に行うことができます。
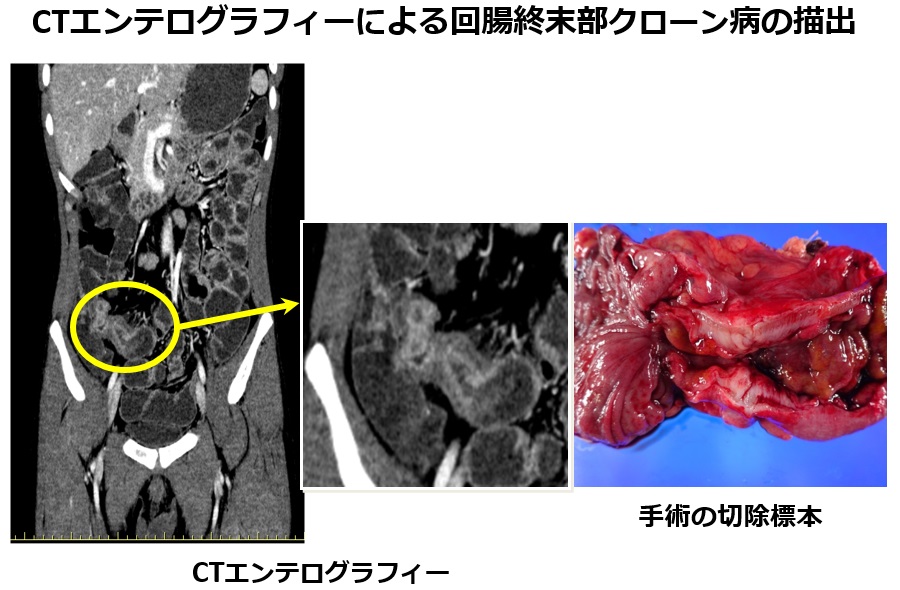
クローン病の患者さんにおいて、CTエンテログラフィーによって明瞭に描出しえた病変部の画像を下図にご呈示します。回腸の終末部に腸管の壁が肥厚して腸管の内腔が狭窄しているクローン病変が鮮明に描出されました。この患者さんは後に回盲部切除術を受けられましたが、切除標本の写真を見るとCTエンテログラフィーの病変の描出能がいかに優れているか理解していただけると思います。
内科的治療
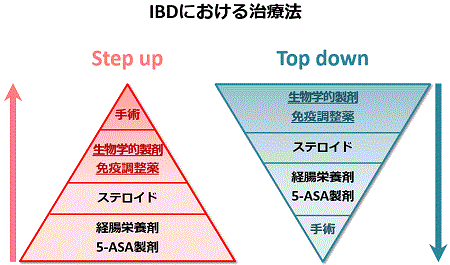
IBDにおける各種治療薬の位置づけを示します。疾患の活動性や難治性が高くなれば、原則として下図の左側のように、下段から上段へ治療法が Step upしてゆくことになります。下段の方がベースになる治療薬で、効果は緩やかですが、安全性が高いと言えます。内科的治療が無効な場合は、最終的に手術が必要になります。欧米では、最初に効果の確実な薬剤から開始して、上段から下段へうつるTop downが注目されています。日本でもTop downの考え方が少しずつ広がっています。Step upとTop downは一概にどちらの方が良いかは言えませんが、各々の患者さんの病態や社会的背景などを考慮して最も良い治療を選択してゆく(オーダーメード治療) 必要があります。それぞれの治療法で、重要なポイントを分かりやすく解説します。
5-ASA製剤
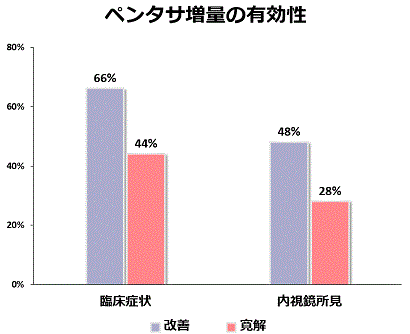
ペンタサ・サラゾピリン・アサコールなどの薬剤を指します。一般に内服しますが、経肛門的に投与する方法があります。これらの薬剤は、主に軽症の患者さんや寛解状態に至った患者さんに使用されます。ただ、少量では効果が見られないこともあり、十分な量を投与する必要があります。最近、活動期の潰瘍性大腸炎において、ペンタサを4g/日まで内服する(一般にペンタサ500mgを朝食後と夕食後に4錠ずつ)ことができるようになりました。当院でも従来のペンタサ投与量(2.25g/日)で臨床症状が消失しない患者さんに4g/日まで増量すると症状が改善した患者さんが見られます。この有効性は、最近当院も参加した全国規模の臨床試験で証明されています。当院では、ペンタサ2.25g/日で寛解維持中だった潰瘍性大腸炎の患者さんが下痢や下血で再燃した際に、ステロイドを用いずにペンタサの容量を4g/日まで増量することでどれだけ臨床症状や内視鏡所見が改善するかを調査しました。増量8週間後には、グラフに示すように66%の患者さんの臨床症状が改善し、44%で臨床症状が消失しました。
また、内視鏡所見でも48%の患者さんで改善し、28%で炎症所見がほぼ消失しました。ペンタサの増量による重篤な副作用は見られませんでした。このようにステロイドを用いずにペンタサの増量により病態が改善する患者さんが多くみられることが分かりました。これらの所見はとくに軽症の患者さんで認められ、再燃した際の臨床症状が軽いときは、まずペンタサの容量を増やすことは安全で有効であると考えています。
また、ペンタサを内服していても直腸やS状結腸など肛門に近い病変が良くならないことがあります。これは、ペンタサの腸管内での濃度が徐々に低下し、肛門近くの大腸で十分効果を発揮していない可能性があります。これらの患者さんには注腸薬が有効です。炎症が強い時はうまく注入できないこともありますが、寛解状態になったときは投与できるようになります。ペンタサは、軽症例の寛解導入に有効です。また、寛解時に投与することで再燃率を下げる効果(寛解維持効果)があることが報告されています。
最近はアサコールという新しい薬剤が使用できるようになりました。ペンタサが時間依存性放出で上部小腸からすでに5-ASAの放出が始まるのに対して、アサコールはpH依存性の放出機構を有しておりpHが7以上になる回腸の終末部から5-ASAの放出が始まります(下図)。したがって、大部分の 5-ASAが大腸内で放出され、直腸にも十分な濃度の薬剤が到達するため、当院ではペンタサを内服していても直腸病変が改善しないような場合でしかも注腸が施行できないときにアサコールの内服を開始しています。
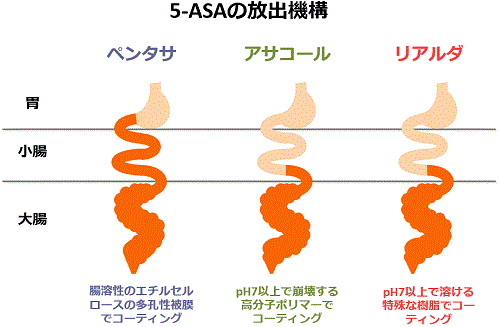
また、最近では潰瘍性大腸炎において、5-ASA製剤をきちんと服用している患者さんは、服用していない患者さんと比較して大腸癌の発生率が低いことが報告されています。5-ASA製剤は毎日きちんと服用する事をお勧めします。
最近、リアルダという新しい5-ASA製剤が潰瘍性大腸炎に対して使用できるようになりました。リアルダ錠では、MMX(マルチマトリックス)という新しい放出機構が用いられています。アサコールと同様にpHが7以上のアルカリ性の条件で溶けるように特殊な樹脂でコーティングされています。さらにリアルダのコーティングの中には、親油性基材と親水性基材に含有される形でメサラジンが入っており、錠剤が大腸内に入り腸液が薬剤に浸入すると親水性基剤はゲル化して膨張します。さらに親油性基剤が腸液の浸入を抑えることでメサラジンが徐々に大腸の中に放出されるように設計されています。このように直腸までの大腸全域に緩徐にメサラジンが放出されて、持続的に薬剤効果が発揮されるようになっています。通常、成人では1回2錠(2400 mg)が1日1回、活動期(軽症や中等症)には1回4錠(4800 mg)が1日1回食後に服用されますが、患者さんの状態により適宜減量されます。このように1日1回の内服で良いというのがリアルダの大きな特徴です。5-ASA製剤の問題点は、患者さんが薬剤を忙しさなどから飲まなかったり、飲み忘れてしまうことなので、1日1回の内服で良いというのは大きなメリットとなります。当院でも従来の5-ASA製剤の服薬が守れない患者さんや効果が十分でない患者さんには、本剤を導入するようにしています。
経腸栄養療法
経腸栄養療法は一般にクローン病の患者さんで行われます。患者さんの栄養状態を改善するだけでなく、活動期の患者さんを寛解に導いたり、寛解を維持させる効果があります。当院でも約70%のクローン病患者さんが栄養療法を行っています。成分栄養剤は、窒素源が抗原性を持たないアミノ酸のみで構成され、脂肪の含有量が極めて少ないため、消化を必要とせず腸管の安静を保ちながら栄養補給を可能にします。
当院の経腸栄養療法は、細いチューブを患者さん自身が鼻から胃まで挿入し(経鼻経管法)、成分栄養剤をポンプを用いて注入する方法で夜間眠っている間に行います。一般的にエレンタール4パック(1200 mL=1200 kcal)を注入します。経鼻経管法は、成分栄養剤を飲むことができない患者さんに有用で、夜間に栄養補給でき日中は食事をおいしく摂ることできるという利点があります。
当院では、IBDチームのメンバーが全員、鼻からチューブを挿入して栄養剤を注入する体験をしました。
この方法を毎日続けるのは大変かもしれませんが、可能であれば是非続けてほしいと思います。また、成分栄養剤を経口摂取できる患者さんは飲んでおられます。最近は栄養剤のフレーバーもずいぶん改善されました。ただ、栄養剤を大量に飲むことは難しいので、栄養剤のみでは不足するカロリーを食事で摂取する必要があります。



当院では、寛解期の患者さんは、在宅で夜間に栄養剤の注入を行い必要カロリーの約半分を摂取し、残りのカロリーを日中の低脂肪食で摂っています(ハーフED法)。食事内容については、管理栄養士が指導を行っています。
当院での経腸栄養療法の有効性を示します。薬剤で寛解に至った患者さんを対象にすると栄養療法を行った患者さんと行わなかった患者さんでは、1年後の寛解維持率は行った患者さんの方が高率でした。術後に栄養療法を行った患者さんと行わなかった患者さんでは、やはり栄養療法を行った患者さんの方が治療成績は良好でした。

これらのデータを分析すると、当院での栄養療法を1年間行うとクローン病の患者さん2~3人に1人の割合で、再燃や再発を防止することができることになります。このような理由から、当院ではクローン病の患者さんにはできるだけ栄養療法を続けるように指導しています。
ステロイド
ステロイド(プレドニン)は、急性期の強い症状(発熱、腹痛、下痢、下血など)を改善するのに有用です。ペンタサや栄養療法だけで効果が見られない時に、ステロイドを数日間投与するとこれらの症状が著明に改善することがよくあります。しかし、ステロイドには様々な副作用があります。とくに長期に使用すると骨粗鬆症になったり、骨頭壊死などの重篤な副作用が起こることがあります。子供に使用すると成長障害を来たすこともあります。また、術前に長期間大量にステロイドを投与されていると術後に重篤な感染症が起こりやすくなります。
| ステロイドの副作用 | ||
|---|---|---|
|
|
|
 重篤な副作用 重篤な副作用 |
||
ステロイドには症状改善作用はあっても腸管の病変を改善する効果はあまりありません。したがって、ステロイドで症状が良くなっても活動性の病変が残存しており、ステロイドを減量したり中止したりするとすぐに症状が再燃してしまうことがよくあります。結局、 ステロイドを中止することができず、服用していると調子が良いため少量であれ漫然と投与されることがあります。このような状態をステロイド依存症といいます。このような状態になってしまうと、ステロイドから離脱することが難しくなってしまい、将来副作用に苦しむことにもなりかねません。このようなステロイド依存症になってしまった患者さんには、当院では次に述べる免疫調整薬の投与や顆粒球除去療法を行い、ステロイドからの離脱を試みており成果を上げています。
新しいステロイド治療薬(ゼンタコート・レクタブル)
ゼンタコートは、新しいステロイド治療薬(糖質コルチコイド)であるブデソニドを小腸および結腸近位部(盲腸や上行結腸)で徐々に放出するように設計された内服薬です。ブデソニドは局所で強力な抗炎症作用を発揮しますが、肝臓での初回通過代謝を受けやすいため、全身への副作用が軽い特徴があります。このように従来のステロイド薬より安全性が高いために、ペンタサや経腸栄養剤で十分な効果が得られない際に、推奨されている薬剤です。一般的には、投与開始8週間を目安に本剤の必要性を検討して、漫然と投与を継続しないようにします。また、本剤を中止する場合は、用量を徐々に減量することが必要です。本邦では、2016年から保険収載されて使用されています。まだ十分なデータは得られていませんが、クローン病の治療薬として安全性と有用性が期待されています。
また最近、ブデソニドの注腸フォーム製剤であるレクタブルが、直腸およびS状結腸の活動性の潰瘍性大腸炎に対して使用できるようになりました。泡状のため薬剤が腸内にとどまりやすく、肛門から漏れにくいというメリットがあります。立ったまま注入できるので使用しやすく、局所作用型で全身副作用が少ないことから安全性も高くなっています。通常、成人には1回あたり1プッシュで、1日2回直腸内に噴射します。投与開始6週間を目安に必要性を再検討して、漫然と投与を継続しないようにします。当院でも、従来の坐剤や注腸薬で効果がみられなかった患者さんに使用して良好な治療効果が得られています。
血球成分除去療法
IBDの病因の一つとされる活性化された白血球を体外循環で除去し、症状や腸管の病変を改善する日本から開発された治療法です。顆粒球除去療法 (GCAP)と白血球除去療法(LCAP)という方法があり、当院ではGCAPを行っています。GCAP治療の詳細は以下のサイトをご覧ください。
「顆粒球吸着療法」
http://www.ibd-nandarou.jp/karyu_02_01.php
2000年から潰瘍性大腸炎に保険適応となり当院でも多くの患者さんがGCAPを受けています。GCAPの標準治療では、1回治療時間は60分で、週に1回の頻度で5週間(合計5回)行います。当院では最近は治療時間を90分に延長して、症例によっては週に2回の頻度で合計10回行い、その効果を最大限引き出そうとしています。
当院で経験したGCAPの副作用は、頭痛や発熱など一過性で軽いものが多く、重篤なものはありませんでした。GCAPは安全な治療法です。有効性では中等症の患者さんには効果的(寛解導入率70%)でしたが、重症例への有効性は高くありませんでした(寛解導入率11%)。当院でGCAPを行った全症例でみると45%の患者さんが治療後に臨床的に寛解に至りました。内視鏡の観察でも、高度な炎症所見がGCAP後に改善することを経験しています。ステロイド依存症だった患者さんが、GCAPを行うことで腸管病変が改善し、ステロイドから離脱できるケースも経験しています。
最近、当院ではGCAP治療によりどれぐらいの患者さんで粘膜の炎症所見が改善するか、また粘膜の炎症が改善した患者さんとそうでない患者さんでその後の臨床経過がどのように異なるのかを調査しました。その結果、GCAP治療により粘膜の炎症がほぼ正常の状態にもどった(粘膜治癒と呼びます)患者さんはGCAP治療を受けた27%に見られました。臨床症状が寛解に至った患者さんの中で、内視鏡で粘膜治癒を起こしていた患者さんといなかった患者さんで、その後の寛解維持率を比較すると、下図に見られるように明らかに粘膜治癒を起こしている患者さんで寛解維持率は高率で、逆に粘膜治癒が起こっていない患者さんでは早期に再燃が見られました。これらの所見から、当院ではGCAP終了時に臨床症状が改善しても内視鏡検査を行い、粘膜治癒が起こっていない患者さんには繰り返してGCAPを行ったり、免疫調整薬の投与を考慮して、再燃を防止するようにしています。
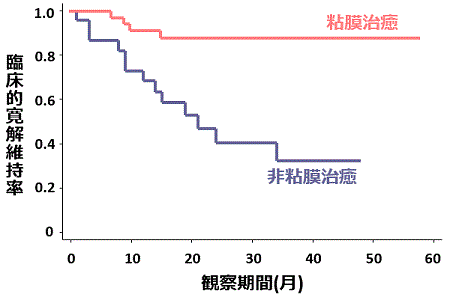
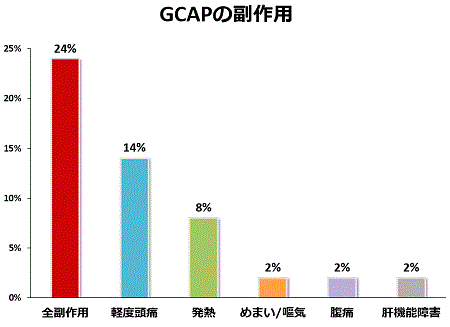
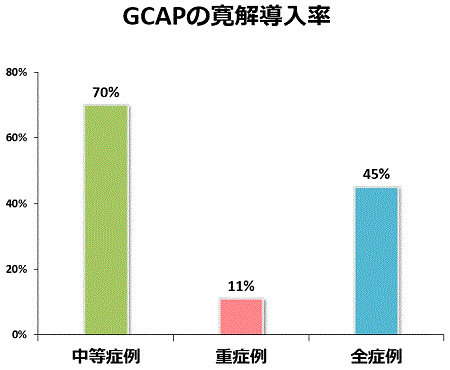
GCAPの早期導入
当院の研究結果から、GCAPはこれまでにステロイドを投与されたことが無い患者さんでは非常に有効ですが、逆に大量にステロイドを投与されている患者さんには効きにくいことが分かりました。したがって、当院では最近GCAPをステロイドの投与を開始する前の早い段階からも積極的に用いるようにしています。GCAPでステロイドの投与開始時期を遅らせたり、投与量を減少させることができれば、メリットは大きいと考えています。2009年からはクローン病にもGCAPが適応となりましたが、まだどのような患者さんに使えばもっとも効果的かははっきりしないところもありますので患者さんを選んで使用したいと考えています。
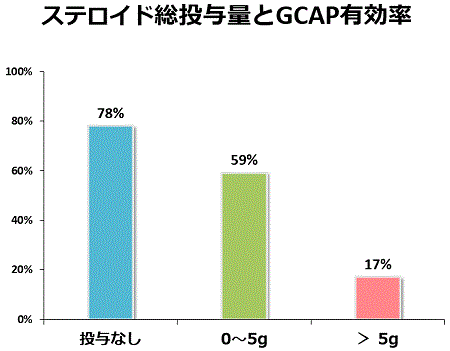
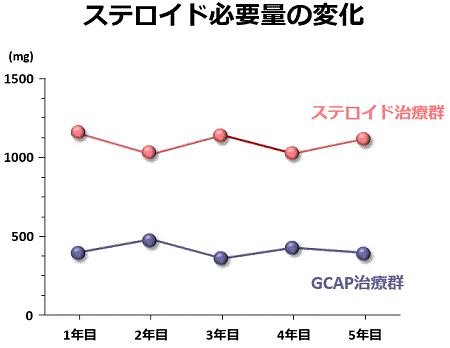
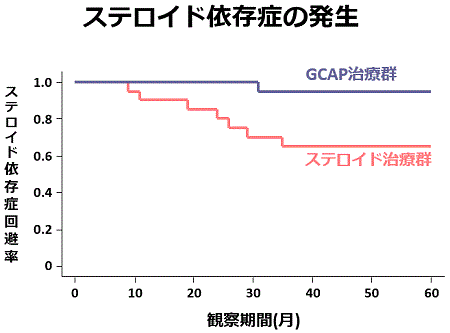
私どもは初回発症の中等症の潰瘍性大腸炎に対してもGCAPを導入しています。可能な限りGCAPを行い、それだけでは不十分な際にステロイドを使用するようにして治療するGCAP治療群とGCAPを行わないでステロイドだけで治療するステロイド治療群では、発症後5年間経過観察すると、再燃の回数は両治療群間で差を認めませんでしたが、ステロイドの総必要量は明らかにGCAP治療群で少なく、また、ステロイド依存症になる患者さんの割合もGCAP治療群で低い事が分かりました。すなわち、GCAPを発症早期から導入することで、ステロイドの使用量を減らすことができ、その結果、依存症になる患者さんの率も減らす事が出来ました。
免疫調整薬
欧米では免疫調整薬はかなり前からIBDの治療に使われており、その安全性と有効性は高く評価されています。日本では2006年からようやくイムランという免疫調整薬がIBDに対して保険認可されました。イムランは、従来の薬剤(5-ASA製剤やステロイド)で治療が困難な患者さんや先述したステロイド依存症になっている患者さんに対して主に投与されます。当院でも治療困難例に対してイムランの投与を行っていますが、寛解導入できて長期間寛解を維持できている患者さんが多くみられます。イムランには、ステロイドには見られない腸管の病変(とくに潰瘍)を治す効果があります。内視鏡による観察で、深い潰瘍がイムランを数ヶ月間投与していると驚くほどきれいに治っていることをよく経験します。ステロイド依存症だった患者さんが、イムランの投与でステロイドから離脱できるケースも経験しています。
しかし、イムランには副作用が見られます。消化器症状(悪心、嘔吐、食欲不振など)は比較的高頻度で見られ、肝機能障害、白血球数減少、関節痛、脱毛などが見られることもあります。投与開始3ヶ月間ぐらいは、とくに症状に留意し採血を頻回に行う必要があります。これらの副作用が見られた際には、減量または中止する必要があります。効果は投与して2~3ヶ月ぐらいして緩徐に現れることが多く、3~4年間内服を継続することが望ましいと言われています。
2009年からは、タクロリムス(プログラフ)という免疫調整薬も保険認可され潰瘍性大腸炎の患者さんに対して投与することが可能となりました。プログラフは血中濃度を測定しながら使う内服薬で、ステロイド依存性やステロイド抵抗性になっている患者さんに投与されます。当院でも難治性の潰瘍性大腸炎の患者さんに使用していますが、非常に有効で多くの患者さんで臨床症状が改善します。しかし、現在では3ヶ月間の使用しか保険診療上認められていないため、投薬中止後に悪化してしまう患者さんが少なからず見られます。寛解をできるだけ長く維持するために、長期間の投与が承認される事が望まれます。
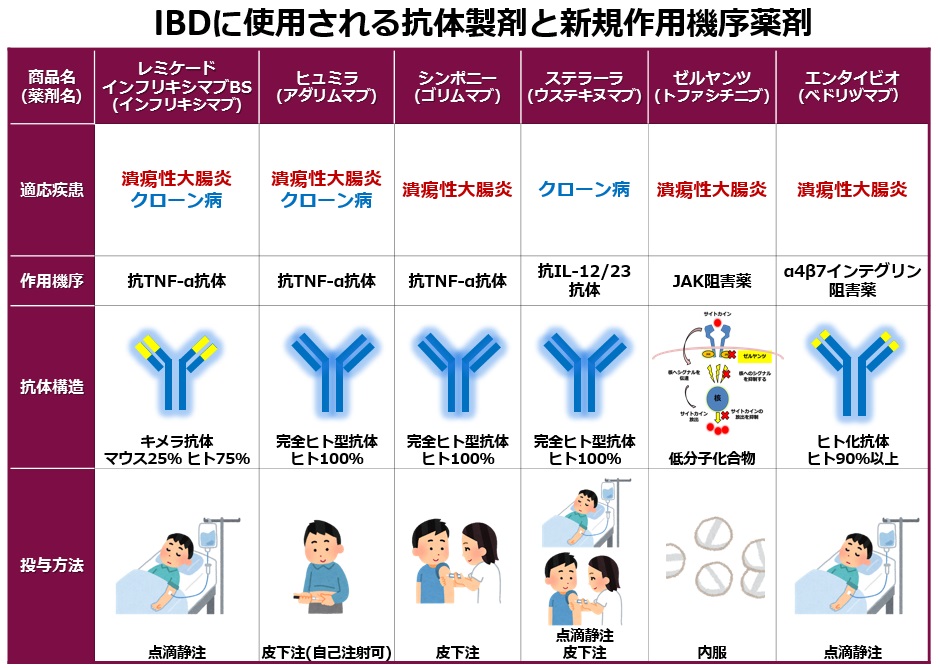
抗体製剤と新規作用機序薬剤
IBDの薬剤治療の進歩は目覚ましく、とくに抗TNF-α抗体製剤(レミケードやヒュミラ)は難治性の患者さんに優れた治療効果と生活の質の向上をもたらしました。最近、さらにシンポニー、ステラーラという新たな抗体製剤が保険承認されました。また、ゼルヤンツ、エンタイビオというこれまでとは作用機序が異なる薬剤が治療選択肢に加わりました。以下の表に現在本邦で保険収載されている抗体製剤や新規作用機序薬剤の概要をお示しします。ここでは、それぞれの薬剤の概要と当院での使用経験ついてお示しします。
抗TNF-α抗体製剤
・レミケード・インフリキシマブ
レミケードは、TNF-α(腫瘍壊死因子)というサイトカインを阻害して治療効果をもたらす抗TNF-α抗体製剤ですが、クローン病の治療の歴史を変えるほどの効果をもたらしました。本邦では、2002年から活動期のクローン病に適応となり、2007年からは寛解導入後にも維持投与ができるようになりました。また、2010年からは潰瘍性大腸炎にも適応となりました。インフリキシマブは、先行薬のレミケードに対するバイオシミラー(バイオ後続品)で、現在レミケードと同様に使用することができます。レミケードは、原則として5 mg/kg体重を、初回、2週間後、6週間後に点滴注射し、その後は8週間毎に点滴注射します。レミケードは、ステロイドを含む従来の治療法が無効であった患者さんに投与されます。非常に高い有効性が報告されており、当院でも従来治療薬で寛解に至らなかった患者さんの約70%がレミケードで寛解導入できました。その後8週間毎の維持投与で寛解を維持しています。当院の経験ではレミケードはとくにクローン病では大腸型に有効で、深い潰瘍がみられ腹部症状が高度な患者さんでは投与数日後には著明な効果が現れます。粘膜の潰瘍が驚くような速度で治癒することが確認されています。
また、潰瘍性大腸炎では、クローン病でみられるほど迅速に著明な効果が得られることは少ないように感じますが、継続して投与することにより、寛解導入が可能となりその後も寛解が維持される患者さんが多くみられます。重症例にも有効で、手術回避効果も認められています。副作用についてですが、私どもの経験では、レミケード投与中に重篤なインフュージョンリアクション(点滴時反応)がみられ治療が中止された方も少数おられますが、ほとんどの患者さんで安全に投与ができています。しかし、感染症や悪性腫瘍の発現などには常に注意が必要で、専門医のもとで治療が行われることが望まれます。
当院では術後に症状が見られなくても内視鏡で病変がある患者さんを対象にレミケードの投与を行い、内視鏡の病変が改善し臨床的な再発を予防できることを報告しました。それらのデータをもとに術後再発防止を目的にした薬剤療法を行っています(後述します)。すなわち、術後6ヶ月の時点で内視鏡検査を行い、高度な内視鏡所見がある患者さんにはレミケード投与を開始し、そうでない患者さんにはこれまでの治療を継続しています。
しかし、レミケードも万能ではなく、最初から効かない患者さんもおられますし(一次無効)、初めは効果があっても何度か投与していくうちに効果が減弱してゆく(二次無効)患者さんも少なからず見られます。効果が減弱している患者さんでは、投与間隔を短くしたり、1回の投与量を増やしたりして対応しています。それでも効果がない際は、その他の抗体製剤や潰瘍性大腸炎ではプログラフのような強い免疫抑制剤に治療を変更しています。
レミケードの患者さん向け情報
http://www.ifx-navi.net/
・ヒュミラ
ヒュミラは、ファージディスプレイ法を用いて世界で初めて開発・承認された完全ヒト型の抗TNF-α抗体製剤ですが、「自己注射」できるという利便性から、多くの患者さんに用いられています。ステロイドを含む従来の薬剤で効果が見られなかった患者さんやそれらの薬剤の副作用が重篤で使用できない患者さんを対象に導入されます。当院では、多くの患者さんで最初の抗体製剤としてヒュミラを用いています。ヒュミラは、初回は160 mg、2週間後に80 mg、その後は2週間毎に40 mgを皮下注射します。病院で注射の方法の指導を受けた後は、患者さん自身が注射する「自己注射」が可能な薬剤です。自宅で自己注射が可能ですので、点滴治療と比較すると薬剤治療による拘束時間をかなり短縮することができ、忙しい患者さんに適しています。当院の経験では、中等症の活動期のクローン病患者さんに対して、ヒュミラを2回投与したところ、4週間後には約60%の患者さんに症状改善効果が見られ、20~30%の患者さんで症状がほぼ消失しました。また、ヒュミラ40 mgを2週毎に継続投与したところ、多くの患者さんで症状改善効果が維持されました。効果減弱のみられた際には、クローン病患者さんではヒュミラの倍量投与(80 mg)を行っています。倍量投与でも効果がみられないときは、他の抗体製剤に切り替えています。
ヒュミラの患者さん向け情報
http://www.e-humira.jp/pt_index.html
・シンポニー
シンポニーは、完全ヒト型の抗TNF-α抗体製剤です。本剤は2017年に保険収載され、活動期の潰瘍性大腸炎で開始することが可能です。本薬剤は、トランスジェニックマウス法という特殊な方法を用いて精製されています。抗薬物抗体の出現率が非常に少ない薬剤です。臨床試験では3.5%の出現率であったと報告されています。初回に200 mg、2週間後に100 mg、以後は4週間ごとに100 mgの皮下注射を行います。ヒュミラとの違いは、病院で皮下注射を行う必要があるという点です。当院では、ステロイドなどの従来薬剤で治療が困難な中等症の潰瘍性大腸炎に対して、治療のタイミングが遅れないように比較的早い段階で用いるようにしています。
シンポニーの患者さん向け情報
https://www.simponi.jp/pts_uc/about_simponi/tnf_alpha/
このように現在、潰瘍性大腸炎では3種類、クローン病では2種類の抗TNF-α抗体製剤の使用が可能であり、今後、これらの薬剤をどのように使い分ければ良いかを検討してゆきたいと考えています。
抗IL-12/23p40モノクローナル抗体製剤
・ステラーラ
ステラーラは、2017年に保険収載されたクローン病に対する新規薬剤です。IL-12およびIL-23というサイトカインを標的にこれらを阻害することで、炎症を改善させます。抗TNF-α抗体製剤とは異なる炎症性サイトカインの流れを抑制する薬剤であり、新しい治療選択肢として期待されています。投与方法は、初回導入療法として体重に応じた薬剤量を点滴で投与します。その後、8週間後に90 mgの皮下注を行い、以後は8週間毎または12週間毎に、外来で皮下注射を行います。当院では、抗TNF-α抗体製剤に対する効果が減弱した患者さんに導入していますが、ステラーラにしてから治療効果が長く続くようになったと満足されている方が多くみられます。また、結節性紅斑などの皮膚病変を認める患者さんでは、ステラーラ導入後、これらに著明な改善がみられています。
ステラーラの患者さん向け情報
https://www.stelara.jp/
JAK阻害薬(ヤヌスキナーゼ阻害薬)
・ゼルヤンツ
ゼルヤンツは、2018年に保険収載され、活動期の潰瘍性大腸炎に対して導入できる新規薬剤です。本剤は、細胞内のJAK(ヤヌスキナーゼ)という酵素を阻害して免疫反応に関わるサイトカインの働きを抑えることで、効果を発揮する内服薬です。抗体製剤と違う低分子化合物という範疇の薬剤になり、したがって他の薬剤とは異なった機序で効果を発現します。既存の治療薬(ステロイド、免疫抑制剤、抗体製剤)で効果がみられない潰瘍性大腸炎の患者さんに導入されます。通常、成人には1回10 mgを1日2回8週間、経口投与されます。なお、効果が不十分な場合は、さらに8週間投与することができます。その後は、1回5 mgを1日2回、経口投与されます。効果が減弱した患者さんでは、1回10 mgの1日2回投与に増量することができます。また、過去の薬物治療において難治性の患者(抗TNF-α抗体製剤無効例など)では、1回10 mgを1日2回投与することができます。当院でも本剤の使用を開始しましたが、難治性の潰瘍性大腸炎にも関わらず、早期に効果がみられた患者さんが複数おられ、今後その有用性が期待されます。本薬剤は、先述した抗体製剤、プログラフ、イムランとは併用することはできません。本剤の使用中には、重篤な感染症の発現や悪化には十分に注意する必要があります。とくに日本人患者さんで認められた日和見感染症のうち多くが重篤な帯状疱疹であったと報告されています。
抗α4β7インテグリン阻害薬
・エンタイビオ
エンタイビオは、2018年に保険収載され、従来の薬剤で効果がみられない潰瘍性大腸炎の患者さんに対して開始できる新規薬剤です。本剤は、細胞接着分子であるα4β7インテグリンに結合してリンパ球の遊走を抑えて効果を発現します。既存治療薬と作用機序が異なることから抗TNF-α製剤で効果が不十分な方やステロイド抵抗性の患者さんにおいて、効果が期待されています。通常、成人には1回300 mgが点滴注射されます。点滴時間は約30分程度であり、比較的短い時間で投与が可能です。初回後は、2週間および6週間後に投与され、それ以降は8週間隔で点滴注射されます。比較的安全な薬剤と言われていますが、感染症などの副作用の発現に注意が必要です。また、3回以上投与しても効果がない場合、本剤を継続して使用するかどうかは、患者さんの症状や副作用の状況などを考慮して、判断する必要があります。まだ、使用経験が限られているためどのような患者さんにどのようなタイミングで導入すれば良いのかは明らかではありませんが、本薬剤は効果発現が比較的ゆっくりしているため重症に至る前の早いタイミングで導入するのが良いのではないかと考えています。
その他の新規薬剤と同様、今後、治療成績を集積して、これらの薬剤の最適な使用方法を明確にする必要があります。
エンタイビオの患者さん向け情報
http://entyvio.jp/home.html
IBDと癌のリスク
IBDの患者さんには発癌の危険性があり、注意が必要です。潰瘍性大腸炎では、診断後10年を経過すると発癌の危険性が徐々に増加し、20~30年経つとかなり高率になります。したがって、発症後長期間経過した患者さんは症状がなくても年に一度は大腸内視鏡検査を受けることをお勧めします。クローン病でも長期経過例で、小腸や大腸に癌が見られることが最近報告されています。痔瘻に合併する肛門癌は発見が難しく、専門医による診断が必要になります。診断後長期間経過したIBDの患者さんは、癌も念頭においた診察や検査を受ける必要があります。5-ASA製剤の項で述べたように、5-ASA製剤には潰瘍性大腸炎における癌化のリスクを下げる作用があることが示唆されています。
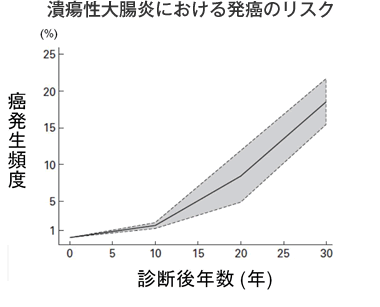
(Gut 2001年 Eadenらの図を改変)
また、内視鏡検査の必要性は、癌を見つけるためだけでありません。治療において最も重要な検査です。患者さんの臨床症状と内視鏡の病変の程度が一致しないことがよくあります。たとえば、臨床症状が無くても高度な病変がある場合もあり、これらの患者さんでは症状が無いからといって治療を緩めてしまうとすぐに再燃することにもなりかねません。また、内視鏡の病変が治っている患者さんには漫然とステロイドを投与する必要はありません。このように内視鏡検査は、治療方針を決めていく上で有用な情報を提供してくれます。
外科的治療
手術適応のIBDの患者さんは、一般に栄養状態が悪くステロイドが投与されており、免疫力が低下しています。そのため手術時期が遅れると、腹腔内膿瘍などの重篤な術後合併症を起こす危険性が高くなります。高度の腹腔内膿瘍を併発した患者さんでは、再手術が必要になったり、永久に人工肛門になってしまうことがあります。したがって、ステロイドや免疫調整薬などの投与を長期間行い漫然と手術時期が遅れてしまうことは避けなければなりません。そのため、内科医から外科医へのコンサルトのタイミングが非常に重要となります。しかし、施設によってはIBD専門外科医がいないため、手術のタイミングを決定するのが難しい状況にあります。当院では、外科医が中心となってIBDの治療を行っているためそのようなことはありません。他院の内科医から手術に関するコンサルトがあり手術が必要と判断した際には、できるだけ早急に患者さんに転院していただき手術を行っています。
また、当院ではこれまでの経験から、患者さんが安全に手術を受けて早期に回復できるように、独自の周術期管理のプログラムを作成して手術治療を行っています。例えば、術後合併症のリスクを予測するために、多職種医療チームが連携を取り、栄養状態、免疫抑制状態(薬剤治療歴)、病変範囲や病型、重症度などを評価しています。術前状態を改善しえる際には、可能な限りそれらに対する治療を行い、患者さんの状態を改善してから手術を行うようにしています。また、患者さんの手術に対する不安を和らげるために精神的・心理的なサポートも行い、術後の社会復帰のための支援も行っています。手術方法は、患者さんの状態や病状に合わせて選択するようにしています。例えば、全身状態が極めて不良で合併症のリスクが高い患者さんには、初回手術では腸管吻合を避けて一時的な人工肛門を造設して、次回の手術で吻合を行い、人工肛門を最終的に閉鎖するような分割手術法を導入しています。このように、患者さんが安心して手術を受けて、しかも、早期に回復して社会復帰ができるように、多職種のスタッフが協力し合い周術期管理を行っています。
潰瘍性大腸炎の手術
潰瘍性大腸炎の患者さんの手術適応を示します。
絶対的適応
大量出血・穿孔・腹膜炎・中毒性巨大結腸症
癌や前癌病変
相対的適応
難治性
薬剤の副作用
必ず手術が必要な絶対的適応と患者さんのためには行った方が良いと考えられる相対的適応があります。大量出血・穿孔・腹膜炎・中毒性巨大結腸症 (大腸の動きが止まり腸管が拡張して、大腸内に毒素やガスがたまってしまう状態などを認める際は、生命維持の為に緊急手術を行う必要があります。また、癌や高度の前癌病変が発見された患者さんも速やかに手術を行う必要があります。手術適応で最も多いのが相対的な適応の難治性病態で、薬剤療法の効果が不十分で、頻回にまた長期間入院加療が必要で、社会生活が満足のゆくように送れないような場合です。この適応はそれぞれの患者さんのおかれた生活状況に大きく左右されますので、絶対的なものではありません。私自身は潰瘍性大腸炎の手術は後述する腹腔鏡技術の導入も加わり大きく進歩したため、長期間の薬剤療法で重篤な副作用で苦しんだり、慢性炎症で発癌のリスクの高い患者さんは手術も重要な治療の選択肢であると考えています。
潰瘍性大腸炎の手術は一般的に分割手術を行います。
2期分割手術
- 大腸全摘+回腸嚢肛門(管)吻合+回腸人工肛門
- 回腸人工肛門閉鎖 (1の3ヶ月後)
3期分割手術
- 結腸全摘+回腸人工肛門
- 残存直腸切除+回腸嚢肛門(管)吻合+回腸人工肛門(1の約半年後)
- 回腸人工肛門閉鎖 (2の3ヶ月後)
先述したような重篤な状態で緊急手術になるような場合は手術を3回に分けて行います(3期分割手術)。また、比較的状態の良い患者さんでは2回に手術を分けて行います(2期分割手術)。分割手術を行う理由は、潰瘍性大腸炎の患者さんでは、ステロイドや免疫調整薬を使用して免疫状態が不良なことや栄養状態が悪いことが多いため、1回で手術を終わってしまうと術後合併症が起こった際に重篤になるリスクが高いからです。このような重篤な合併症が永久人工肛門の原因になることもあります。
潰瘍性大腸炎の標準術式では、大腸をすべて切除します(大腸全摘)。その後に便の貯留機能を持たせる目的で、回腸終末部を用いて回腸嚢(Jパウチ)を作成して先端を肛門あるいは肛門管と吻合します。
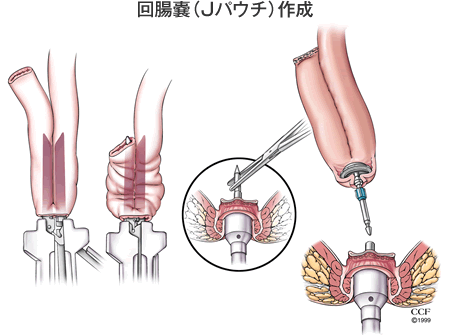
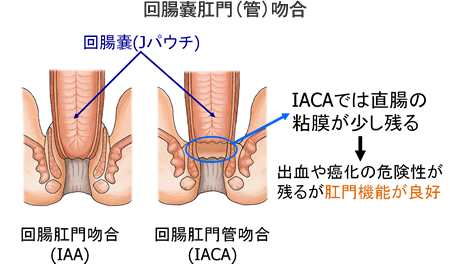
吻合法には上図に示すように、回腸肛門吻合(IAA)と回腸肛門管吻合(IACA)の2つの主要な方法があります。IAAは肛門から術者が手縫いで吻合します。IACAは自動吻合器を用いて吻合します。どちらの方法も長所と短所があります。IACAは少し直腸の粘膜が残りますが、残存粘膜からの大量出血や癌のリスクは非常に少なく、またIAAと比べて術後の漏便(後述します)が少なく排便機能が良好です。当院ではこれまでIAAを行っていましたが、最近はほぼ全症例にIACAを導入しています。下部直腸癌が見られる患者さんでは残存直腸粘膜を残さないようにIAAを行っています。
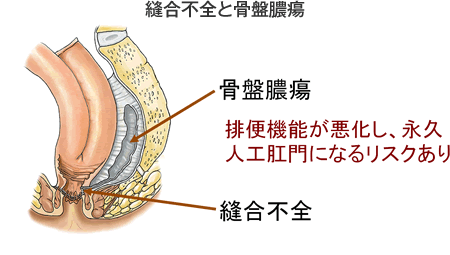
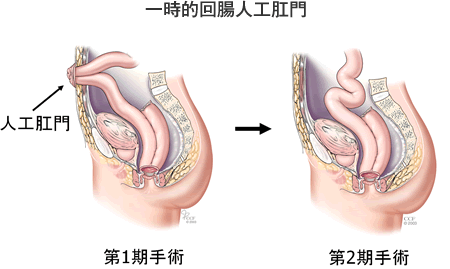
回腸嚢と肛門(管)の吻合部が縫合不全を起こしてしまうと骨盤膿瘍が遷延して肛門機能が極めて悪くなり(上図)、永久人工肛門を余儀なくされることがあるため、一般に回腸嚢と肛門(管)を吻合した際には、その吻合部を保護する(便を通さないようにする)目的で、回腸に人工肛門を造設します。吻合部に問題がないようなら約3ヶ月後に人工肛門を閉鎖します(上図)。したがって、患者さんはしばらく人工肛門で日常生活を送る必要があります。しかし、それほど長い期間ではありませんし、人工肛門の創は小さくきれいに治りますので、それほど苦痛なものではありません。一時的な人工肛門は患者さんに危険を回避して良好な術後成績を提供するための手技であることをご理解ください。一方、65~70歳を超える高齢の患者さんでは、肛門を締める筋肉の機能が落ちていることがあり、人工肛門のまま過ごしていただいた方が良好な生活を送っていただける場合もあります。
腹腔鏡手術のメリット
潰瘍性大腸炎では、大腸を全切除して回腸終末部でJ型回腸嚢を作成し肛門管と吻合する大きな手術が行われます。手術に際しては、高度な技量と十分な経験が必要になります。当院でのIBDの手術例数は年々増加しており、患者さんからより満足度の高い手術が要求されるようになりつつあります。そのような背景から2005年8月より用手補助下腹腔鏡手術(Hand Assisted Laparoscopic Surgery: HALS)という手術方法を導入しています。2007年からは緊急症例にもHALSを適応しており、現在では潰瘍性大腸炎のほとんどの手術でHALSを行っています。また、クローン病ではHALS(おもに大腸病変)に加え、さらに傷の小さな腹腔鏡手術(おもに小腸病変)も行っています。
HALSの1番のメリットは、整容性(傷跡の綺麗さ)が優れていることです。当院のHALSでは、潰瘍性大腸炎では下腹部に7cmの横切開を置き、術者が手を挿入します。(この傷跡は下着で隠れます)。 臍部から腹腔鏡を挿入し腹腔内を観察しながら、左側腹部に1cmの小切開を置いて手術器具を挿入して手術を進めます。従来の開腹手術創とHALSの手術創を比較すると大きな違いがあります。実際の患者さんの傷跡をお示しします。
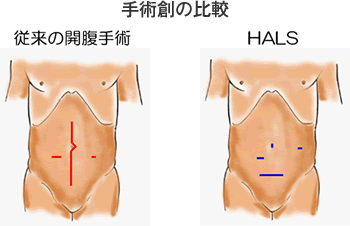
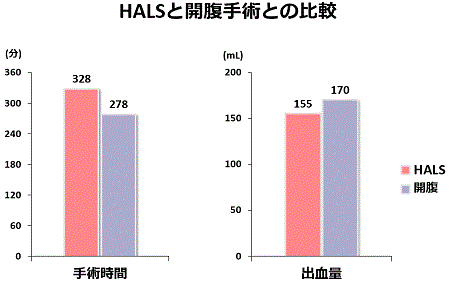
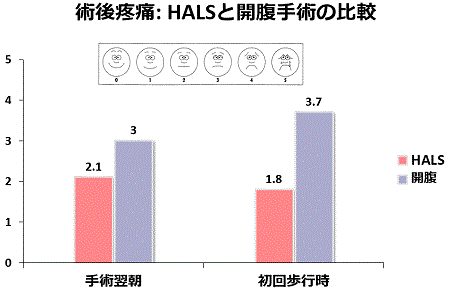
当院では、HALSはこれまで全例に対して安全に行うことができ術中に大きな偶発症を経験していません。手術時間は開腹手術と比較して長いですが、術中出血量では大きな差を認めませんでした。術後の痛みは、手術翌朝も初回歩行時もHALSは開腹手術と比較して軽度でした。
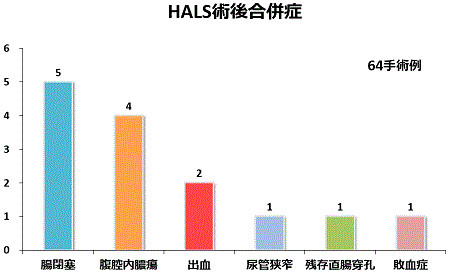
当院で最近HALSを行った潰瘍性大腸炎64症例では、14例に術後合併症が見られました。最も多かったのは腸閉塞で、5例に見られそのうち1例が腸閉塞を解除する再手術を要しました。他の4例は保存的に軽快しています。次に多かった合併症は、腹腔内膿瘍4例でそのうち1例が再手術を要しましが 3例は人工肛門が造設してあったため保存的に軽快しました。術後合併症率は、開腹手術例と比較しても有意な差を認めず、HALSは従来の手術と変わらず安全に行えることが分かります。
クローン病に対しても大腸切除の際にはHALSを行っていますが、小腸病変にはさらに傷が小さい(4~5cm程度)腹腔鏡手術を導入しています。クローン病の外科治療において、小腸に多数の病変が存在する際の手術は最も難しいとされています。最近、当院でも小腸に多数の狭窄がある患者さんの手術を何度か行いました。1例をご紹介します。20歳の男性で腸閉塞を来たし手術となりましたが、小腸全域に多数の狭窄病変を認め、もし切除すると小腸がほとんど残存しないような状態でした(手術写真)。
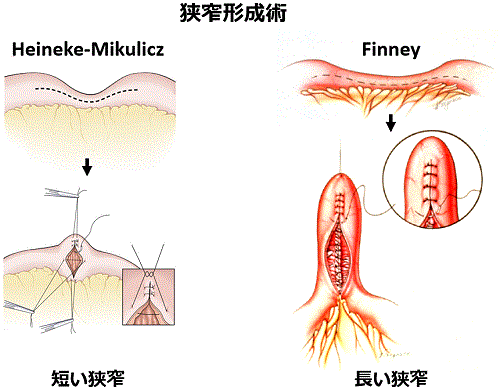
そこで、狭窄形成術という狭窄部を切除せずに拡張する手術を行いました。腹腔鏡手術で行ったので小さな傷で行うことができ、腸管を全く切除せずに手術が行えました(手術写真)。術後に腸閉塞は消失し、患者さんは現在も寛解状態を維持しています。このように小腸病変に対しては、狭窄形成術を用いることで腸管を切除することなく治療することができます。小腸を大量に切除して短腸症候群になってしまうと、生涯経静脈栄養を行わなくてはいけなくなってしまいます。
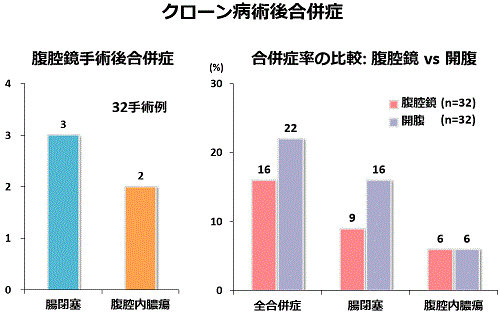
当院で最近経験したクローン病に対する腹腔鏡手術32症例では、3例に腸閉塞、2例に腹腔内膿瘍の術後合併症が見られました。開腹手術例とこれらの合併症率を比較しましたが、有意な差を認めませんでした(下図)。したがって、腹腔鏡を用いた手術は従来の開腹手術と同じように安全であることが分かります。当院では、クローン病に対しても、前回手術の影響で腹腔内に高度な癒着を認める患者さんや腹腔内に高度な膿瘍や腫瘤を形成しているような患者さんを除いては、可能な限り腹腔鏡を用いた手術を行っています。
単孔式腹腔鏡手術
最近、当院では小腸クローン病の狭窄病変に対して、1ヶ所の創のみで行う腹腔鏡手術(単孔式腹腔鏡手術)を導入しています。臍部に小さな (3cm程度)切開創をおくのみですので、術後はほとんど創は分からなくなります。整容性に極めて優れており、とくに若年女性の方にはメリットの大きな術式です。当院で行った単孔式腹腔鏡手術後の傷跡をお示しします(写真)。
まとめとして、腹腔鏡手術の利点を示します。
- 術後の傷跡が小さい
- 術後の痛みが軽い
- 術後の回復が早い
このように、痛みが少なく整容性に優れた手術を行うことで、患者さんの術後の満足度も高く、今後手術に対する抵抗も少なくなればと期待しています。
大腸全摘術後の排便機能
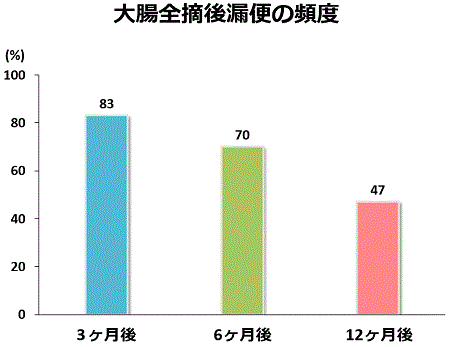
潰瘍性大腸炎で大腸全摘術を行った患者さんでは、水分を吸収し便を固形にしていた大腸がなくなるので、常に水様便~泥状便になり、排便回数が術前の寛解期よりむしろ多くなります。しかし、排便回数は時間の経過とともに少しずつ減少して1年後ぐらいには個人差はありますが、だいたい一日5~10回ぐらいに落ち着きます。また、大腸全摘術後は、夜間に熟睡しているときに漏便といって便を漏らしてしまうことがあります。その頻度(漏便を認める患者さんの割合)もグラフに示すように時間の経過とともに少なくなります。肛門の筋肉がしっかりした若年の患者さんでは、全く漏便を経験したことがない方もおられます。大腸全摘術後は、術前より排便回数が増えてしまったり、漏便を経験したりして、排便に悩まされることもありますが、当院のアンケート調査によるとほぼ全員の患者さんが病気や薬剤(ステロイドや免疫調整薬)から解放され手術をして良かったと感じておられます。
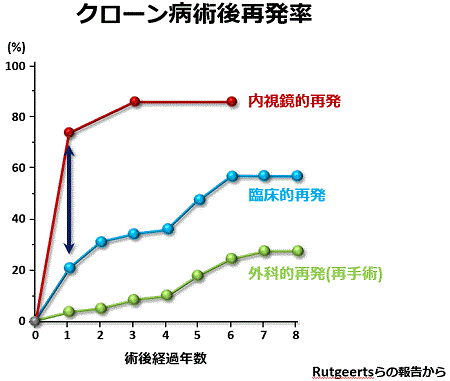
クローン病術後再発予防策
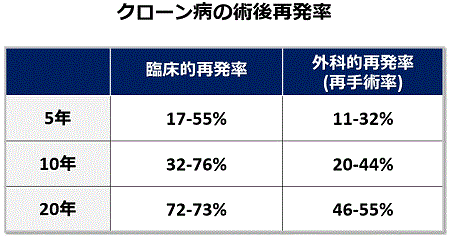
クローン病術後の大きな問題点は再発率が高いことです(下図)。しかし、術後早期に再発を起こし再手術が繰り返し必要になる患者さんがいる一方で、長期間再発なしで過ごしておられる患者さんもいます。当院では、これまでどのような患者さんに術後再発が多いのか、いわゆる再発危険因子を求めて研究してきました。その結果、再発のリスクが高いのは次のような患者さんであることが分かりました。
- 喫煙者
- 病変部が穿孔・瘻孔・膿瘍を呈している(穿孔型病変)の患者さん
喫煙者は非喫煙者と比較すると約2~3倍再手術のリスクが増加します。しかし、禁煙すると術後再発率が下がることが報告されているため、当院ではクローン病の患者さんには禁煙するように指導しています。このホームページをご覧のクローン病の患者さんでタバコを吸っておられる方は是非禁煙してください。また、クローン病の手術適応は、穿孔型病変(穿孔・瘻孔・膿瘍)と非穿孔型病変(主に狭窄)に分かれますが、穿孔型病変の方が非穿孔型病変よりも約1.5倍再手術のリスクが高いことが分かっています。
また、クローン病の術後1年時に、臨床症状の再発を認める患者さんは約20%であるのに対して、内視鏡検査を行うと腸管吻合部付近に70%の患者さんで高度な病変が見られると報告されています(下図)。すなわち、クローン病の術後は症状が見られないにもかかわらず、多くの患者さんで内視鏡的にはすでに病変が進行していることが分かります。当院の調査では術後6ヶ月時に高度な内視鏡病変を認める患者さんはその後に再発しやすく、逆に内視鏡的に病変を認めない患者さんは再発を来たしにくいことが分かりました。このような結果から、当院では今後の治療方針を立てるために術後6ヶ月時に内視鏡検査を行い吻合部付近の病変の有無をチェックしています。
クローン病術後の薬剤治療についてですが、これまでの研究から、5-ASA製剤(ペンタサやアサコール)や抗菌剤(メトロニダゾール)に再発予防効果があることが報告されています。しかし、5-ASA製剤の効果は弱いためメリットが少なく、また、抗菌剤(メトロニダゾール)は副作用があり長期間内服を続けることは困難です。当院の調査の結果、成分栄養剤を用いた経腸栄養療法に再発率を下げる効果があることが示唆されましたが、今後さらなる検証が必要です。最近、当院や他施設の臨床研究で、免疫調整薬や抗TNF-α抗体製剤(レミケードやヒュミラ)に再発防止効果があることが証明されました。レミケードやヒュミラは高価で、感染症などの副作用の可能性があることから、医療経済的にあるいは安全性の面から、すべての術後の患者さんに投与することには賛成できません。当院では、内科的治療の抗TNF-α抗体製剤(レミケード)の項でお示ししたように、術後6ヶ月時に認められた高度の内視鏡病変に対してレミケードが有効で、その後の臨床的な再発を予防する効果があることを報告しました。したがって、術後に内視鏡病変を認めた患者さんを対象に抗TNF-α抗体製剤(レミケードやヒュミラ)による治療を開始するようにしています。
当院での回結腸切除術後の再発予防対策の概要を下図に示します。喫煙者や穿孔型病変を有する患者さんや複数回の手術を受けている患者さんでは、術後早期より免疫調整薬の投与を開始し、一方、これらの因子を有しない患者さんでは5-ASA製剤の投与や経腸栄養療法を行っています。術後6ヶ月時に内視鏡検査を行い高度の病変を認める患者さんには抗TNF-α抗体製剤(レミケードまたはヒュミラ)の投与を開始し、無病変や軽度な病変の患者さんではこれまでの治療を継続しています。ただし、これまでの記述は回腸終末部や回盲部に限局した病変が切除し得た患者さんを対象としており、手術終了時に上部小腸や大腸に活動性病変が残存している場合や残存小腸が短く短腸症候群のリスクが高い際には、術後早期からの抗TNF-α抗体製剤(レミケードまたはヒュミラ)の投与を行っています。また、回腸終末部だけではなく、その口側の小腸における再発病変を早く見つけるために大腸内視鏡前には、先述したCTエンテログラフィー検査を行っています。CTエンテログラフィーで小腸に高度な病変がみられた際にも、症状がなくとも抗TNF-α抗体製剤(レミケードまたはヒュミラ)の投与を開始します。このように症状がなくとも病変が検出された際に、積極的に治療を強化して術後再発を予防する方針は、先に述べたT2T(Treat to target)の治療戦略の一つであると言えます。

当院のクローン病術後の新しい長期の管理方法
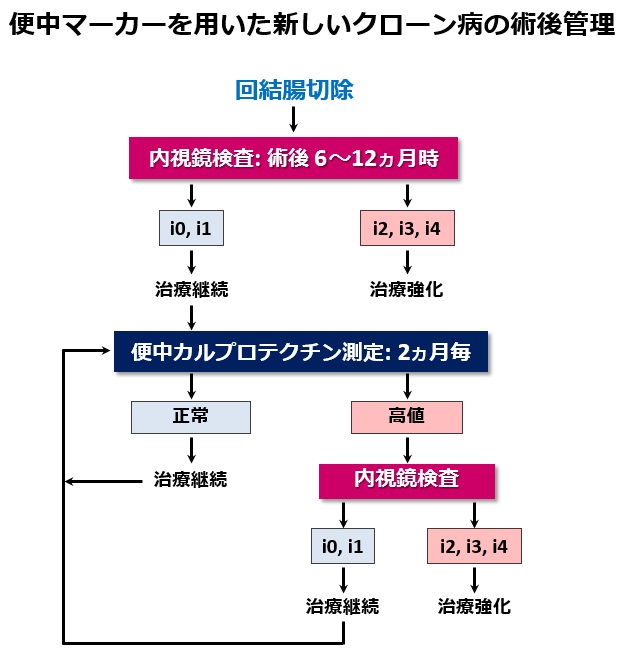
当院での便中カルプロテクチンを用いた回結腸切除術後の新しい管理方法を下図に示します。術後再発管理における内視鏡検査の有用性については先述しました。しかし、患者さんの負担を考えると繰り返して内視鏡を行うことは困難です。当院では非侵襲性な便中カルプロテクチン検査をいち早く術後管理に導入しています。便中カルプロテクチンが術後内視鏡炎症スコアと有意に相関することは当院の研究により証明されています。したがって、当院では長期的な術後管理法として、術後最初(6-12ヵ月時)に内視鏡検査を行った後は、便中カルプロテクチンを定期的(外来時)に測定して、上昇がみられた際には内視鏡検査を行っています。内視鏡的に再発が確認された際には、抗TNF-α抗体製剤の導入などのように薬剤治療を強化します。逆にカルプロテクチンが低値を維持している患者さんでは、侵襲の大きい内視鏡検査は行わずに治療を継続しています。このように非侵襲な便中カルプロテクチン検査を導入することで、有効なクローン病の長期の術後管理が可能となると考えています。
妊娠や出産について
とくに女性のIBDの患者さんは、妊娠や出産について大きな不安を持っておられると思います。しかし、それほど心配はいりません。適切な知識を持っておられれば、安全に妊娠や出産をすることができます。IBDの患者さんは、妊娠する率が一般女性より低いという報告もありますが、それほど変わらな いという報告も多く見られます。IBDの患者さんでは妊娠や出産に対して不安が強すぎて自分から妊娠を諦めておられる方もみえるようで、そのことが妊娠率が低い原因になっている可能性もあります。ただ、潰瘍性大腸炎の手術後には卵巣や卵管の癒着などのため、妊娠率が低下するという報告はあります。しかし、 当院でも術後に無事出産されている方もたくさんおられますので心配はいりません。クローン病の患者さんでは、高度の肛門病変や膣瘻(腸管と膣の交通)のある患者さんでは、経膣分娩は避けて帝王切開が行われます。
IBDでは、寛解期に妊娠した患者さんでは、活動期に妊娠した患者さんより、出産までの経過が良好で正常に出産できる確率が高いとされます。すなわち、病気の調子が良い時期に妊娠した方が、より安全に出産できるということです。活動期に妊娠してしまうと病態が悪化して、さらに強い薬剤を使わないといけなくなったり、妊娠中に手術が必要になってしまうこともあります。 妊娠中の薬剤についてですが、妊娠したからといってすぐに医師から処方されている薬剤を自己判断で止めてしまうことは避けた方が良く、医師に必ず相談してください。妊娠2週から12週までは器官形成期と呼ばれ、薬剤による催奇形作用を受けやすい時期です。それを過ぎると薬剤による催奇形作用の可能性は低くなります。
妊娠中の投薬
これまでよく用いられてきた妊娠中の薬物治療の安全性に関するFDAの胎児危険度分類基準は2015年6月から廃止されました。5-ASA製剤(サラゾピリン・ペンタサ)やステロイド(プレドニン)は、妊娠中も比較的安全とされています。ただし、サラゾピリンには抗葉酸活性があるため、妊娠早期には葉酸の投与が望ましいとされています。ステロイドは、妊娠初期はなるべく少量の方が望ましいとされています。また、エレンタールによる栄養療法中には、過剰に摂取してビタミンA過剰(奇形の原因になりうると報告されています)にならないように注意することが必要です。アザチオプリン(イムラン)、6-MP(ロイケリン)、シクロスポリン(サンディミュンやネオーラル)、タクロリムス(プログラフ)は、注意しながら投与する必要があるとされていますが、臨床的には有意な催奇形性や胎児毒性は証明されていません。これらの薬剤の投与を受けている患者さんが妊娠した際は、薬剤の必要性を判断しなければならないので、主治医とよく相談する必要があります。インフリキシマブ(レミケード)やアダリムマブ(ヒュミラ)は、妊娠中期以降は胎盤を能動的に通過して胎児に移行するので、可能なら妊娠24~26週で中止するのが好ましいとされています。健康な妊婦においても流産、早産、奇形などは一定の頻度で起こります。重要なことは、妊娠したからといって自己判断ですぐに治療薬を中止してしまわないことです。中止したためにIBDが重症化して妊娠の継続が困難になってしまうリスクもあるからです。したがって、主治医とよく相談したうえで、薬剤の継続について決定する必要があります。
授乳中の投薬
母乳は乳児にとって最適な栄養とされています。IBD治療薬の授乳への影響についてですが、ほとんどの薬剤は程度の差はあれ、母乳中に分泌されます。5-ASA製剤(サラゾピリン・ペンタサ)、ステロイド、抗体製剤(レミケードやヒュミラ)は授乳中に使用しても問題ないとされています。アザチオプリン(イムラン)、6-MP(ロイケリン)は、母乳への移行は少なく授乳可能な薬剤であるとされています。抗菌剤のメトロニダゾール(フラジール)やシプロフロキサシン、シクロスポリン(サンディミュンやネオーラル)、タクロリムス(プログラフ)は、可能であれば授乳期には使用を避けた方が良いとされていますが、病状を考慮しなければならないので、主治医とよく相談してください。
乳児期のワクチン接種
IBDの母体から出生した児においても、乳幼児期のケアは健常児と基本的には変わりありません。ワクチン接種については、以下に述べることに注意する必要があります。現在は、生後2ヵ月~1歳までの乳児期に6種のワクチン接種が推奨されています。それらのうち、不活化ワクチンには、B型肝炎(HBV)、インフルエンザ菌b型(Hib)、肺炎球菌(PCV13)、四種混合(DPT-IPV; ジフテリア、百日咳、破傷風、ポリオ)があり、一方、生ワクチンには、ロタウイルス、BCGがあります。麻疹風疹混合(MR)、水痘、おたふくかぜも生ワクチンですが、1歳以降に接種されます。免疫を抑制する治療を行っていた母体から出生した乳児では、ガイドラインによると、出生後6ヵ月未満の生ワクチンの接種は避けなければなりません。ロタウイルスやBCGのワクチンがこれにあたります。一方、不活化ワクチンは、スケジュール通り接種して良いとされています。現行の予防接種のスケジュールをよく理解して、免疫抑制治療を受けていた母体からの出生児ではワクチン接種を行う必要があります。
最後に
当院のIBD治療における業績や成果の一覧をお示しします。興味のある方はご覧ください。
これらについて、詳しい内容をお知りになりたい方はご連絡ください。
先述しましたように、近年、IBDの治療の進歩は目覚ましく、抗TNF-α抗体製剤や免疫調整薬はIBD治療の歴史を変えるほどの効果をもたらしました。また、続々と新規薬剤が日常臨床で使用できるようになりつつあります。当院でもこれらの新しい薬剤を導入することで、優れた治療成績を達成することが可能になりました。しかし、抗体製剤や免疫調整薬を含む新規薬剤には感染症などの副作用の可能性があり、長期の使用に関しては安全性に不安があります。また、これらの薬剤には、薬剤間で程度に差はあるものの、効果減弱が起こる可能性もあり、その際のレスキューの治療法についても今後さらに検討する必要があります。また、多くの薬剤が使用できるようになった反面、これらの薬剤をどのような順序で導入してゆけば良いかについても明確な指針はありません。さらに、これらの新規薬剤は概してかなり高額であるため、医療経済も考慮した使用法が必要となります。
最新の内科的治療を駆使しても治療困難な場合には、適切な時期に手術を行う必要があります。IBDの手術は、腹腔鏡技術の導入により大きく変わりつつあります。当院でも大腸切除に用手補助下腹腔鏡手術(HALS)、また、小腸クローン病にも腹腔鏡手術を導入し、従来の開腹手術と比較すると大きな飛躍を遂げました。腹腔鏡手術の大きな利点は、術後の傷跡が小さく目立たないことや痛みが少ないことです。傷跡が目立たないことは、若年者の多いIBD患者にとっては大きなメリットです。このような満足度の高い手術を行うことで、今後IBD患者の手術に対する抵抗が少なくなり、早期に社会復帰が可能となると信じています。また、患者さんが安心して手術を受けることができ、しかも、早期に社会復帰ができるように、多職種のスタッフが連携を取り合い協力することで周術期管理を行っています。精神的あるいは心理的なサポートや術後の社会復帰のための支援も積極的に行っています。手術術式についても、患者さんの全身状態や病態の重症度を考慮して術後合併症のリスク評価を十分行ったうえで、安全な方法を選択しています。
先述したように、IBDの治療は、新薬や新しい手術方法が生まれ格段に進歩しました。しかし、難治性のIBDに苦しむ患者さんは増加しているように感じます。これらの新しい治療をどのような患者さんにどのように活かしてゆくかは今後の大きな課題です。私どもIBDチームは、これからも患者さんが安心して満足のゆく質の高い治療を受けられるように努力したいと思っています。是非、私たちIBDチームと一緒に難治性のIBDと闘いましょう。
当院IBDセンターを受診されたい方は下記(代表)にお電話頂き、外科外来のスタッフに受診希望とお伝えください。ご予約を承ります。
四日市羽津医療センター
TEL:059-331-2000(代表)










